En la superficie de nuestras neuronas se libra una batalla invisible que puede desatar enfermedades devastadoras. Hasta ahora, espiarla era imposible. Pero un equipo del CONICET acaba de lograrlo por primera vez, combinando la microscopía más potente del mundo con una inteligencia artificial que refina la mirada y revela los secretos del caos molecular.
Los receptores de neurotransmisores son las «cerraduras» de nuestras células nerviosas. Su correcto funcionamiento es crucial para que todo, desde un pensamiento hasta el movimiento de un músculo, ocurra sin problemas. Cuando estas proteínas fallan o se agrupan de forma anómala, pueden ser el punto de partida de enfermedades neurológicas y neuropsiquiátricas como la miastenia gravis o el Alzheimer. El problema es que ver este proceso en acción, en una célula viva y a una escala nanométrica, era hasta ahora una barrera infranqueable para la ciencia.
Un equipo del CONICET, liderado por el científico Francisco Barrantes, acaba de derribar ese muro. Utilizando una combinación de tecnología de punta, lograron por primera vez en el mundo visualizar en forma directa la dinámica de uno de estos receptores clave interactuando con el colesterol de la membrana celular. Un avance publicado en dos artículos en la prestigiosa Nature Communications.
Un ojo superpoderoso y un cerebro artificial
Para lograr esta hazaña, el equipo del Instituto de Investigaciones Biomédicas (BIOMED) utilizó dos herramientas revolucionarias. La primera es uno de los microscopios de superresolución más avanzados del mundo, construido con la ayuda del premio Nobel alemán Stefan Hell, que permite observar células vivas a una escala ínfima sin destruirlas en el intento.
Pero la imagen cruda no era suficiente. Aquí es donde entra en juego el segundo componente clave: la inteligencia artificial. «Gracias a la IA nosotros estamos refinando las imágenes que obtenemos del microscopio (…) y nos permiten extraer información adicional e interpretar las imágenes con mayor precisión y detalle», explica Barrantes. Su equipo, que incluye a jóvenes expertos en computación, desarrolló algoritmos de deep learning y redes neuronales capaces de analizar las complejas trayectorias de las moléculas y cuantificar cómo se agrupan. «Estamos pudiendo abordar aspectos antes inalcanzables», agrega el científico.
Viendo el principio de la enfermedad
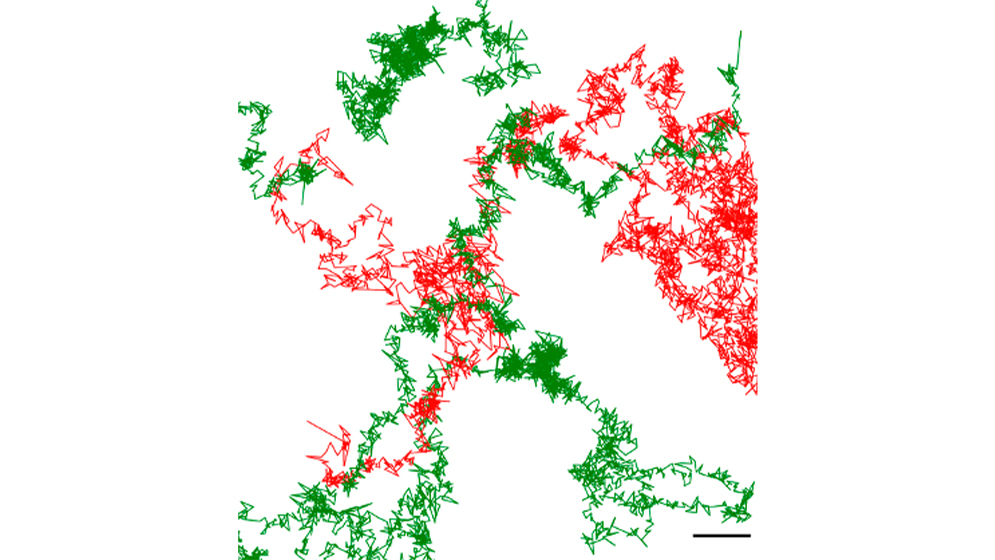

¿Y qué es lo que vieron exactamente con esta tecnología combinada? Pudieron observar en tiempo real cómo el receptor nicotínico de acetilcolina (nAChR) se mueve y se organiza en la superficie de la célula. Y en ese movimiento, detectaron el origen de la patología.
«Ver cómo se desplaza un receptor en la superficie de una célula patológica nos ha permitido detectar aquellos que forman agregados supramoleculares, acúmulos, lo que en el ser humano señala el comienzo de enfermedades autoinmunes como la ´miastenia gravis´», detalla Barrantes. Esta enfermedad, que destruye estos receptores y causa una parálisis progresiva, podría ser diagnosticada mucho antes gracias a esta técnica.
El potencial de este «ojo» aumentado por la IA es enorme. «Seguir utilizando estas técnicas nos va a permitir entender cuáles son los factores de la superficie celular que gatillan la acumulación patológica de receptores», asegura el investigador. El mismo principio se está aplicando para estudiar la agregación de proteínas en otras patologías como el Alzheimer.
Como concluye Barrantes, la inteligencia artificial ha llegado para quedarse en la medicina, y su aporte es «fabuloso». Este trabajo es la prueba de cómo la combinación de la física más avanzada y la computación más innovadora puede iluminar los rincones más oscuros de la biología humana y abrir nuevas esperanzas para el diagnóstico y tratamiento de enfermedades que, hasta hoy, veíamos demasiado tarde.
Referencias:
Barrantes, F.J. (2022). Fluorescence microscopy imaging of a neurotransmitter receptor and its cell membrane lipid milieu. Front. Mol. Biosci. 9, 1014659.
Barrantes, F.J. (2024). Modulation of a rapid neurotransmitter receptor-ion channel by membrane lipids. Front. Cell Dev. Biol. 11, 1328875.
Buena Maizón, H. & Barrantes, F.J. (2021). A deep learning-based approach to model anomalous diffusion of membrane proteins: the case of the nicotinic acetylcholine receptor. Briefings in Bioinformatics 23, bbab435.
Kellner, R. Baier, J., Willig, K.I., Hell, S.W. and Barrantes, F.J. (2007). Nanoscale organization of nicotinic acetylcholine receptors revealed by STED microscopy. Neuroscience 144, 135–143.
Mosqueira, A., Camino P.A. and Barrantes, F.J. (2018). Cholesterol modulates acetylcholine receptor diffusion by tuning confinement sojourns and nanocluster stability. Sci. Rep. 8: 11974.
Mosqueira, A., Camino P.A. and Barrantes, F.J. (2020). Antibody-induced crosslinking and cholesterol-sensitive, anomalous diffusion of nicotinic acetylcholine receptors. J. Neurochem. 152, 663-674.
Saavedra, L. A, Mosqueira, A. & Barrantes, F.J. (2024). A supervised graph-based deep learning algorithm to detect and quantify clustered particles. Nanoscale, 2024, 16, 15308 – 15318.
Saavedra, L. A. & Barrantes, F.J. (2025). Temporal convolutional networks work as general feature extractors for single-particle diffusion analysis. J. Physics Photonics 7(2), 025017.
Reina, F., Saavedra, L.A., Eggeling, C. and Barrantes, F.J. (2025). Concurrent diffusion of nicotinic acetylcholine receptors and fluorescent cholesterol disclosed by two-colour sub-millisecond MINFLUX-based single-molecule tracking. Nature Commun. 16, 6336.
Muñoz-Gil… Saavedra, L.A…. Barrantes, F.J. et al. (2025). Quantitative evaluation of methods to analyze motion changes in single-particle experiments. Nature Commun. 16, 6749.

