Un equipo del CONICET desentraña en el Biophysical Journal el mecanismo por el cual la proteína p53, mutada en la mitad de los cánceres, forma “condensados biomoleculares” que evolucionan a amiloides tóxicos, allanando caminos para nuevas terapias e inmunoterapias.
El gen supresor p53, apodado “guardián del genoma”, regula la detención de la división celular ante daños en el ADN o induce la muerte celular programada para prevenir tumores. No obstante, en el 50 % de los cánceres, muta y pierde esa protección; peor aún, algunas mutaciones desencadenan la formación de depósitos amiloides que favorecen la progresión tumoral.
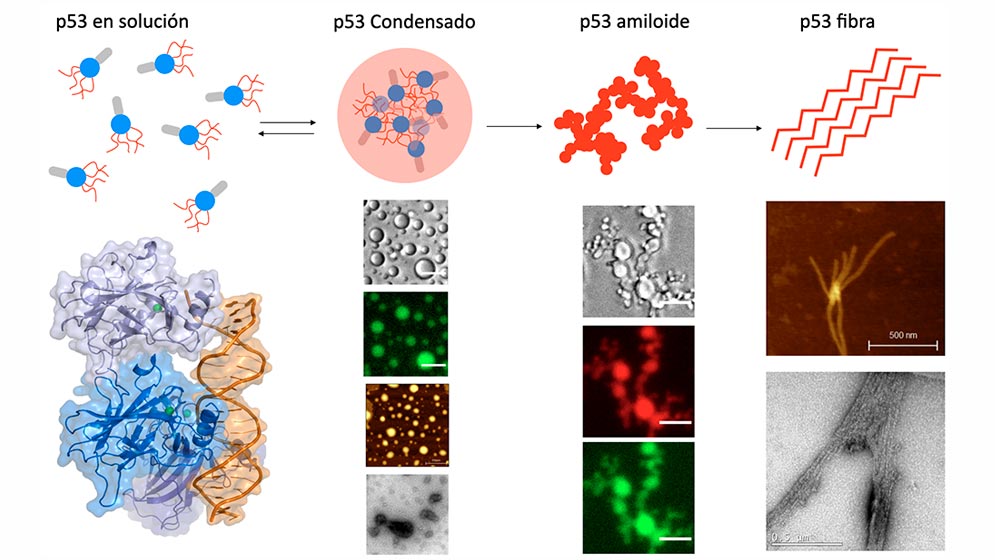
Gonzalo de Prat Gay y Silvia Borkosky (IIBBA–CONICET y Fundación Instituto Leloir) revelan en Biophysical Journal que p53 mutado sufre condensación, formando pequeñas gotas líquidas en el citosol—los llamados condensados biomoleculares—que, con el tiempo, se transforman en estructuras amiloides estables y patológicas . Este proceso es análogo al observado en el Alzheimer y Parkinson, donde proteínas neuronales forman agregados dañinos.
El equipo caracterizó cinéticamente el paso de p53 desde su estado nativo a gotas líquidas y, finalmente, a fibrillas amiloides. En sus ensayos in vitro, registraron:
- Nucleación de gotas: formación de condensados en segundos tras alcanzar concentración crítica.
- Maduración: las gotas crecen y maduran en minutos–horas, capturando moléculas de p53 mutado.
- Transición amiloide: en horas, las gotas pierden fluidez y cristalizan en fibrillas que se acumulan en el citoplasma.
Estos pasos confirman que la agregación por condensación puede desactivar la función supresora de p53 y contribuir activamente al desarrollo tumoral.
El descubrimiento abre varias vías de intervención:
- Pequeñas moléculas que eviten la condensación inicial de p53 mutado.
- Agentes disruptores de las gotas o de la transición a amiloides.
- Inmunoterapias dirigidas contra las formas amiloides de p53, para que el sistema inmune las reconozca como antígenos tumoral-específicos.
- Biomarcadores: anticuerpos monoclonales desarrollados por el grupo podrían detectar estas formas anómalas y servir en diagnóstico temprano o monitoreo de pronóstico.
En la última década, los condensados biomoleculares—“organelas sin membrana”—han surgido como actores clave en procesos como reparación de ADN, sinapsis y respuesta al estrés. Scientific American las describió como “misteriosas gotas que reescriben la biología celular”. Este estudio incorpora a p53 mutado a ese nuevo paradigma, mostrando cómo la alteración del equilibrio de gotas líquidas puede ser motor de enfermedad.

Próximos pasos: desde probeta hasta tejido
Prat Gay señala que los siguientes objetivos incluyen:
- Replicar los hallazgos en células vivas y muestras de tejido humano.
- Mapear los eventos críticos—desde la nucleación de gotas hasta la agregación amiloide—para identificar blancos concretos de fármaco.
- Colaborar con laboratorios clínicos y startups de terapias de condensados para diseñar compuestos capaces de frenar o revertir este proceso nocivo.
«Al revelar cómo p53 mutado secuestra la biología de las gotas celulares para formar amiloides, abrimos nuevas puertas para prevenir y tratar múltiples tipos de cáncer», concluye Prat Gay.
Referencia bibliográfica
Borkosky, S. S. et al. «Experimental kinetic mechanism of P53 condensation‑amyloid aggregation». Biophysical Journal 124, 1658–1673 (2025). https://doi.org/10.1016/j.bpj.2025.04.009

