Investigadores del IBR–CONICET estudian cómo los antibióticos afectan a los biofilms, esas comunidades bacterianas ultrarresistentes responsables de hasta el 80 % de las infecciones crónicas. Buscan compuestos que, administrados en conjunto con fármacos convencionales, desarmen estas ‘fortalezas’ microbianas y devuelvan la eficacia a los tratamientos
Desde lo invisible, las bacterias llevan miles de millones de años enseñándonos al ingenio: al verse rodeadas de amenazas —cambios de temperatura, ambientes hipersalinos o incluso antibióticos— construyen biofilms, estructuras comunitarias que funcionan como tejidos multicelulares. Encerradas en una matriz extracelular propia, estas bacterias forman ecosistemas adheridos a superficies, donde cada estrato cumple un rol vital.
«Casi todas las bacterias tienen la capacidad de formar y vivir en biofilms; incluso se piensa en estas estructuras como el prototipo más antiguo de organismos multicelulares», explica el doctor Diego Serra, líder del laboratorio de Estructura y Fisiología de Biofilms Microbianos en el Instituto de Biología Molecular y Celular de Rosario (IBR–CONICET–UNR).
En un biofilm, las células de la capa superficial trabajan sin descanso para producir los componentes de la matriz: un proceso costoso que las aleja de la fuente de nutrientes. Cuando el alimento escasea, “se duermen”, quedando protegidas de los antibióticos. Solo las bacterias en la base, activas y oxigenadas, caen ante la acción de los fármacos. El resultado clínico es demoledor: entre el 50 y el 80 % de las infecciones crónicas están vinculadas a estos biofilms.
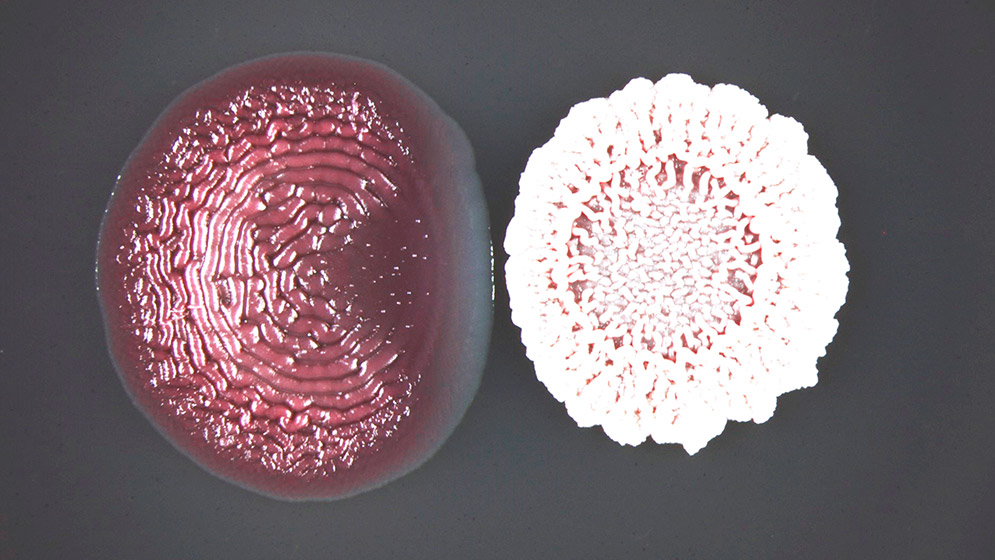
Foto: gentileza investigadores.
La estrategia contra el ultrasólido
El equipo de Serra avanza por dos caminos. Por un lado, investiga cómo toleran concentraciones letales de antibióticos, para idear terapias que penetren hasta las capas más inactivas. Por otro, analiza los efectos de dosis subletales sobre la formación y mantenimiento del biofilm.
«En la práctica clínica, muchas veces el antibiótico llega al tejido infectado en concentraciones bajas —señala Estefanía Cordisco, investigadora posdoctoral en el laboratorio—. Ese nivel subletal no mata, pero genera una señal de estrés que refuerza la formación del biofilm».
Además, residuos de antibióticos fluyen en ríos, suelos y efluentes ganaderos, exponiendo a las bacterias ambientales a concentraciones insuficientes para eliminarlas, pero suficientes para reprogramar su modo de vida en fortalezas comunitarias.
Lluvia de compuestos “moonlighting”
Buscando compuestos que impidan la construcción del biofilm, Serra y su equipo hallaron algo inesperado en Bacillus subtilis: una molécula, la baciloína, que desactiva la matriz sin generar señales de alerta en las bacterias receptoras. «La baciloína inactiva la matriz del biofilm sin que la bacteria se dé cuenta, es decir, sin provocar estrés ni resistencia», describe Cordisco.
Este hallazgo, publicado como portada en Trends in Microbiology, define a los antibióticos como moonlighting, término que evoca sus “segundas funciones” más allá de la simple muerte bacteriana. Al degradar la protección extracelular, abren la puerta para que otros antibióticos lleguen a capas antes inaccesibles.
Hacia tratamientos combinados
La idea ahora es sintetizar derivados de la baciloína o diseñar coadyuvantes que, junto a los antibióticos clásicos, derriben la fortaleza del biofilm y erradiquen definitivamente a las células durmientes. «Concebimos tratamientos sinérgicos que primero desarmen la matriz, y luego maten a las bacterias más vulnerables», resume Serra.
En una era donde la resistencia antimicrobiana amenaza con devolvernos a la Edad Media de las infecciones, descifrar el comportamiento de los biofilms abre un nuevo frente de batalla. Gracias a la larga trayectoria de Diego Serra en Alemania y su compromiso al volver al país, el IBR–CONICET se posiciona como un centro clave para traducir el conocimiento básico en soluciones sanitarias que la sociedad reclama con urgencia.
Referencias bibliográficas:
Cordisco, Estefanía et al. Moonlighting antibiotics: the extra job of modulating biofilm formation. Trends in Microbiology, Volume 33, Issue 4, 459 – 471 (2025). DOI:10.1016/j.tim.2024.12.011Cordisco, E., Zanor, M. I., Moreno, D. M., & Serra, D. O. (2023). Selective inhibition of the amyloid matrix of Escherichia coli biofilms by a bifunctional microbial metabolite. npj Biofilms and Microbiomes, 9(1), 81.. https://doi.org/10.1038/s41522-023-00449-6